В работе использовали специально подобранные комбинации культур Lactococcus lactis. Культуры лактококков представляют собой сферические и овальные клетки размером (0,5– 1,2)Ѕ(0,5–1,5) мкм, в жидкой среде расположенные парами и короткими цепочками. Культуральную жидкость для концентрирования получали путем выращивания комбинации культур в адаптированной питательной среде в ферментере БИОР-0,1. Активная кислотность среды в ходе процесса поддерживалась на требуемом уровне путем непрерывной нейтрализации культуральной жидкости (КЖ) гидроокисью при постоянном перемешивании. Развитие бактерий контролировали по расходу нейтрализующего средства; микробиологическую чистоту – по микроскопическому препарату. При достижении стационарной фазы роста микроорганизмов микробную массу направляли на концентрирование.
Концентрирование культуральной жидкости проводили на лабораторной баромембранной установке с использованием блока ультрафильтрации с половолоконным полисульфоновым мембранным элементом с порогом задержки 25–50 кДа. Установка одноступенчатая с поверхностью фильтрации 3 м2. Производитель мембранного элемента – ГНУ «Институт физико-органической химии Национальной академии наук Беларуси».
Основными показателями процесса отделения биомассы от культуральной жидкости являлись выход концентрата, содержание массовой доли сухих веществ, производительность установки (табл. 1).
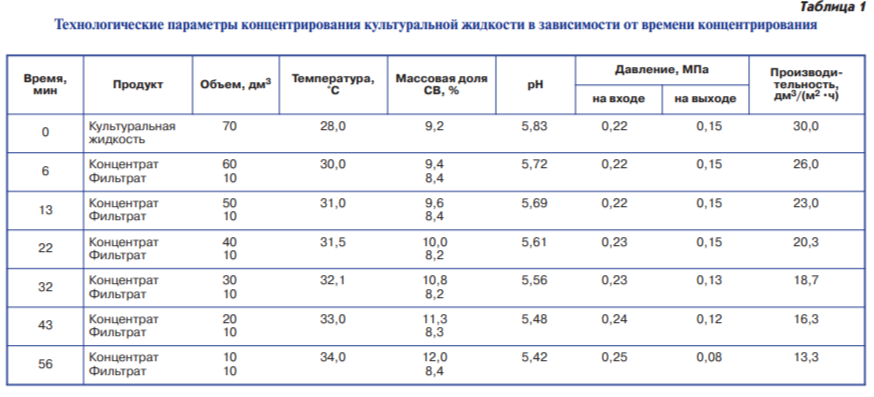
В результате ультрафильтрации культуральной жидкости на мембране данного типа получен концентрат с содержанием сухих веществ 12,0 %. Скорость фильтрации изменялась по мере концентрирования в пределах от 30,0 до 13,3 дм3/(м2•ч) и к завершению процесса снизилась в 2,25 раза. Фактор концентрирования, или коэффициент уменьшения объема (отношение объема полученного концентрата к объему исходной культуральной жидкости), в опыте равнялся 7.
Параметром, определяющим процесс ультрафильтрации культуральной
жидкости, является коэффициент концентрирования – отношение содержания компонента (количества клеток молочнокислых микроорганизмов) в концентрате к его содержанию в исходной культуральной жидкости.
Полученный концентрат был изучен по микробиологическим показателям: фактор
концентрирования по объему – 7; в культуральной жидкости – 6,0•109 КОЕ/г; в концентрате – 3,6•1010 КОЕ г; в фильтрате – 3,0•105 КОЕ/г.
Эффективность процесса и потери бактерий с отходящим фильтратом оценивались, исходя из теоретического равенства:
7• КОЕКЖ = 1•КОЕконц + 6•КОЕфильт,
7•(6,0•109) = 1•(3,6•1010) + 6•(3,0•105),
где КОЕКЖ, КОЕконц, КОЕфильт – соответственно титры клеток в культуральной жидкости, концентрате, фильтрате, КОЕ/г.
Проверка равенства:
4,2•1010 = 3,6•1010 + 1,8•106 = 3,6•1010.
Принципиально можно считать, что
равенство соблюдено. Возможно, за время процесса (почти 1 ч) количество активных клеток могло снизиться естественным образом (отмирание). Уход микроорганизмов в фильтрат на 4 порядка меньше (потери ниже 0,01 %), чем количество бактерий в концентрате. Этими потерями в данном процессе можно пренебречь как незначительной для практических целей величиной.
Влияние давления процесса на скорость концентрирования микробной массы
Выбор рабочего давления зависит от вида процесса, природы и концентрации разделяемого раствора, типа мембраны, конструкции аппарата и др. С увеличением давления возрастает эффективная движущая сила процесса и, соответственно, величина проницаемости мембраны. Процесс разделения осуществляли при 0,12, 0,15, 0,2 и 0,25 МПа. В зависимости от давления изменение скорости фильтрации во времени разkично (табл. 2).
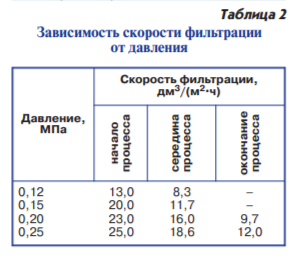
Так, при минимальном рабочем давлении 0,12 МПа в начале процесса скорость фильтрации составила
13 дм3/(м2•ч), при увеличении давления до 0,2 МПа – возросла в 2,1 раза. Однако в процессе работы производительность мембраны начинает снижаться и уже через 20 мин становится в 1,5 раза меньше первоначальной, а через 50 мин концентрирование при давлении 0,12–0,15 МПа останавливается, что приводит к практической невозможности управляемо завершить процесс.
При фильтрации под давлением 0,25 МПа начальная производительность мембраны по фильтрату максимальна – 25 дм3/(м2•ч). Ее снижение в процессе также происходит интенсивно:
через 20 мин фильтрации производительность в 1,4 раза ниже, чем в начале работы, а в конце концентрирования – в 1,92 раза. Динамика изменения КОЕ в фильтрате была следующей: при давлении 0,12 МПа в начале процесса – 4,5•104, в середине – 5,9•106, затем процесс прекращался; при давлении
0,25 МПа – с 8,0•106 до 1,0•107 с последующим падением до 2,0•106, что можно объяснить вероятным образованием слоя фильтрующего осадка на селективном слое мембраны.
Особенности концентрирования различных видов микроорганизмов
Дальнейшие исследования были направлены на выяснение особенностей процесса баромембранного концентрирования микроорганизмов с различными морфологическими вариациями. Для исследований были отобраны штаммы Streptococcus thermophilus 1134-St-AV и 1104-St-AV, Lactobacillus plantarum 2645ML-O, Lactobacillus casei 1189 ML, Lactobacillus acidophilus 1178 LA – AVF, Lactobacillus helveticus 2644 TL-A, Bifidobacterium longum 432-OR.
Streptococcus thermophilus. Культуры термофильного стрептококка широко используются при производстве многих кисломолочных продуктов, в сыроделии – чаще при производстве сыров с высокой температурой второго нагревания. Они растут в широком диапазоне температур, оптимальная температура развития в интервале 40–46 °С, максимальная – 53–55 °С, большинство штаммов этой культуры не растет при температуре ниже 15 °С. Морфологически S. thermophilus представлены грамположительными кокками довольно вариабельных размеров, формы и расположения клеток. У большинства культур клетки круглые диаметром 0,7–1,0 мкм или слегка вытянутые (овальные) толщиной 0,5–0,8 мкм и длиной 0,7–1,0 мкм. В зависимости от индивидуальных свойств культуры, фазы развития, условий культивирования термофильные стрептококки образуют одиночные клетки, диплококки, цепочки кокков. Причем по сравнению с лактококками цепочки кокков имеют большую длину, а сами клетки крупнее.
Концентрирование культуральной жидкости культур Streptococcus thermophilus 1134-St-AV и 1104-St-AV проводили на лабораторной баромембранной установке с использованием блока ультрафильтрации со спиральным мембранным элементом HpHT 8038-K131 селективностью 100 кДа. Количество ступеней – 1; площадь фильтрации – 7 м2. Сгущение осуществляли путем циркуляции культуральной жидкости с отводом фильтрата в мерную емкость.
Количество клеток термофильного стрептококка в культуральной жидкости составило 4,0•108 КОЕ/см3, концентрирование происходило при следующих технологических параметрах процесса: давление – 0,4 МПа, температура – 15 °С. Результаты ультрафильтрации: фактор концентрирования по объему/количеству – 10; содержание сухих веществ в культуральной жидкости – 10,2 %, в коyцентрате – 15,5 %, в фильтрате – 7,5– 9,4 %; производительность по фильтрату – 21,0–3,1 дм3/(м2•ч). Таким образом, в результате ультрафильтрации культуральной жидкости с содержанием сухих веществ 10,2 % получен концентрат с содержанием сухих веществ 15,5 %. Скорость фильтрации в ходе процесса ожидаемо падала. Так, при одном и том же давлении скорость фильтрации в начале процесса составила 21 дм3/(м2•ч), однако в середине процесса она уменьшилась в 1,4 раза, а в конце процесса составила 3,1 дм3/(м2•ч). Средняя по процессу скорость фильтрования составила 11,5 дм3/(м2•ч) пермеата.
Мезофильные лактобациллы. Мезо – фильные лактобациллы широко используются в составе бактериальных заквасок для изготовления сыров, кисломолочных продуктов, а также в составе биоконсервантов для силосования растительных кормов. Применение Lacto bacillus plantarum и Lactobacillus casei в составе лактококковых заквасок повышает устойчивость к воздействию нерегулируемой технически вредной микрофлоры (в основном БГКП, маслянокислых бактерий). Температурный оптимум развития L. plantarum и L. casei составляет 30–32 °С, максимальный – 40–45, минимальный – 10–15 °С.
В морфологическом отношении бактериальные клетки L. plantarum и L. casei представляют собой грамположительные палочки с закругленными концами толщиной 0,5–1,0 мкм, одиночные, парные или в цепочках с разным содержанием клеток. Значительное влияние на морфологию клеток оказывают условия культивирования, а также фаза развития. В благоприятных условиях это кокковидные клетки, в кислых средах – типичные палочки, иногда слегка изогнутые. Влияние фазы развития следующее: в лаг-фазе они представлены в виде тонких палочек, чаще одиночных, в фазе логарифмического роста – слегка вытянутыми клетками с коэффициентом формы от 1,2 до 3,0 мкм, одиночными, парными и короткими цепочками.
Для исследований были отобраны штаммы Lactobacillus plantarum 2645ML-O и Lactobacillus casei 1189 ML. Мем бранное концентрирование культуральной жидкости осуществляли на лабораторной баромембранной установке с использованием блока ультрафильтрации с половолоконным поли – суль фонным мембранным элементом селективностью 25–50 кДа. Количество ступеней – 1, поверхность фильтрации – 3 м2, давление – 0,2 МПа, температура – 15 °С (табл. 3).
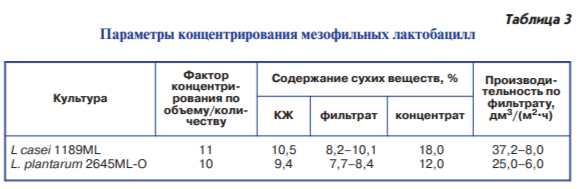
В процессе ультрафильтрации культуральной жидкости мезофильных лактобацилл получены концентраты Lacto -bacillus casei с содержанием сухихвеществ 18,0 % и Lactobacillus plantarum с содержанием сухих веществ 12,0 %. Факторы концентрирования соответствовали коэффициенту уменьшения объема. Средняя скорость выхода фильтрата Lactobacillus casei в исследовании была в 1,6 раза выше средней скорости выхода фильтрата Lactobacillus plantarum.
Термофильные лактобациллы. Lactobacillus helveticus, Lactobacillus acidophilus, Lactobacillus bulgaricus,
Lactobacillus lactis – термофильные гомо ферментативные молочнокислые палочки, которые сбраживают гексозы (молочный сахар) почти исключительно до молочной кислоты, пентозы, не сбраживают глюконат, не образуют углекислый газ. L. lactis и L. helveticus применяют в качестве компонентов в составе
заквасок для сыров с высокой температурой второго нагревания, а L. acidophilus – в качестве пробиотической микрофлоры для изготовления кисломолочных продуктов.
Для исследования процесса концентрирования отобраны культуры Lacto – bacillus helveticus и Lactobacillus acidophilus. Культуры растут в широком диапазоне температур, оптимальное значение температуры развития находится в интервале 37–46 °С, максимальное – 53–55 °С, большинство штаммов этих культур не растут при температуре ниже 15 °С. В морфологическом отношении L. helveticus и L. acidophilus − грамположительные палочки, обычно правильной формы, размером (0,5– 1,2)Ѕ(1,0–10,0) мкм, как правило, длинные, соединенные в короткие и длинные цепочки.
Концентрирование культуральной жидкости проводили на лабораторной баромембранной установке с использованием блока ультрафильтрации с половолоконным полисульфонным мембранным элементом селективностью 25–50 кДа, поверхность фильтрации – 3 м2, давление – 0,2 МПа, температура – 15 °С.
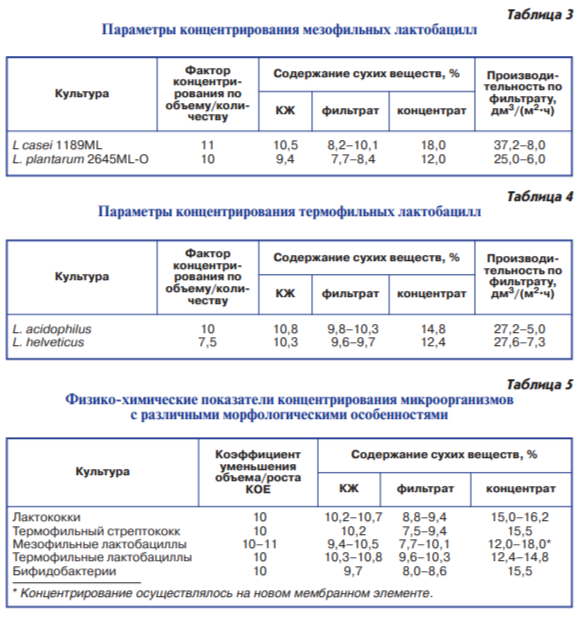
Результаты ультрафильтрации культуральной жидкости термофильных лактобацилл представлены в табл. 4.
В результате концентрирования в 10 раз культуральной жидкости Lacto – bacillus acidophilus содержание сухих веществ 10,8 %, в концентрате увеличилось в 1,4 раза. При этом производительность в конце концентрирования снизилась в 5,4 раза по сравнению с первоначальной. Дальнейшее ведение процесса было нецелесообразно из-за низкой скорости концентрирования. Средняя скорость выхода фильтрата
составила 16,5 дм3/(м2•ч).
После концентрировании в 7,5 раза культуральной жидкости Lacto bacillus helveticus, содержание сухих веществ в концентрате увеличилось от 10,3 % в 1,2 раза. Скорость фильтрации снизилась в 3,8 раза. Средняя скорость выхода фильтрата составила 11,5 дм3/(м2•ч).
Бифидобактерии. Бифидобактерии являются представителями нормальной микрофлоры человека. Они оказывают благоприятное влияние на кишечный микробиоценоз путем подавления (по конкурентному механизму) роста патогенных микроорганизмов в толстом кишечнике и тем самым нормализуют
микрофлору желудочно-кишечного тракта, играющую важную роль в процессах как кишечного всасывания, так и становления и функционирования иммунной системы. Образуют комплекс биологически активных веществ, синтезируют витамины и повышают иммунитет.
Морфологически Bifidobacterium longum – вариабельные по форме палочки, размером (0,5–1,3)Ѕ(1,5–8,0) мкм, несколько изогнутые, булавовидные и часто разветвленные. Темпера турный оптимум развития бифидобактерий – 36–38 °С. Рост штаммов прекращается при 20 °С и ниже, максимальная температура роста в пределах 45–50 °С. Концентрирование культуральной жидкости B. longum осуществляли на лабраторной баромембранной установке с использованием блока ультрафильтрации с половолоконным полисульфонным мембранным элементом селективностью 25–50 кДа, поверхность фильтрации – 3 м2, давление – 0,2 МПа, температура – 15 °С.
Фактор концентрирования по объ – ему/количеству составил 10; содержание сухих веществ в культуральной жидкости – 9,7 %, фильтрате – 8,0–8,6 %, концентрате – 15,5 %; производительность по фильтрату – 26,4–6,0 дм3/(м2•ч).
В результате концентрирования культуральной жидкости бифидобактерий в 10 раз по объему получен концентрат, содержащий 15,5 % сухих веществ. Количество клеток в 1 г концентрата увеличилось в 10 раз по отношению к культуральной жидкости. Средняя скорость выхода фильтрата составила 14,6 дм3/(м2•ч).
Сравнительная оценка показателей концентрирования микроорганизмов с различными морфологическими особенностям
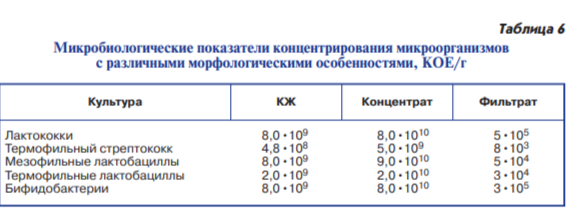
Оценку проводили по физико-химическим и микробиологическим показателям полученных концентратов и фильтратов (табл. 5). Сравнительное исследование физико-химических показателей экспериментальных серий позволяет сделать вывод о том, что концентрирование микроорганизмов не зависит от их морфологических особенностей возможно до содержания сухих веществ 14,8–18,0 % (табл. 6).
При этом увеличение степени концентрирования, вероятно, сдерживается не концентрацией бактерий, а высокомолекулярными соединениями, входящими в состав питательной среды и остающимся в культуральной жидкости
Выводы:
В ходе экспериментов установлено, что мембранными методами достигается степень концентрирования бактерий в 10 раз по сравнению с исходной культуральной жидкостью, что принципиально соответствует степени концентрирования при бактофугировании.
Потери бактерий в отходящий фильтрат с учетом его объема не превышают 0,01 %, что для промышленных методов концентирования более приемлемо.
Литература:
1) Baker, R.W. Membrane Technology and Applications / R.W.Baker. – Chichester: John Wiley & Sons, 2004. – 538 p.
2) Cheryan, M. Ultrafiltration and microfiltration handbook / M.Cheryan. – Lancaster: Technomic Publishing, 1998. – 527 p.
3) McGregor, W.C. Membrane Separation in Biotechnology / W.C.McGregor. – New York: Marcel Dekker, 1986. – 386 p.
4) Zeman, L.J. Microfiltration and Ultrafiltration: Principles and Applications / L.J.Zeman,
5) A.L.Zydney. – New York: Marcel Dekker, 1996. – 365 p.
